肝细胞和胆管细胞自我更新伴随有肝脏的损伤,严重损伤导致肝细胞的衰老越来越多,但是肝祖细胞(HPCs)能否促进肝脏的再生还尚不清楚。近期发表在《Nat Cell Biol》的一篇文章论述了关于肝祖细胞的相关研究成果。文献阅读:Nat Cell Biol 2015 Jul 20.
在这里,我们描述了一个小鼠模型,其中E3泛素连接酶的Mdm2在98%以上的肝细胞被诱导性删除,从而引起表达p21的几乎所有肝细胞的凋亡、坏死和衰老。这就导致HPC的激活,这是生存所必需的,紧接着就是完整的功能性地肝重建。HPCs是使用细胞表面标志物从基因正常的小鼠上分离出来的,是可高度扩展的,并且在体外表型稳定。这些HPC被移植到成年小鼠肝脏中肝细胞Mdm2被多次删除的地方,创建一个非竞争性的再生方式。移植HPCs很显著地作用于肝实质的恢复、肝细胞和胆管上皮细胞的再生,突出其在体内的谱系效力。因此,HPCs在未来肝脏疾病方面是有潜力替代肝细胞或肝移植的。
肝移植是治疗晚期肝脏疾病的唯一有效的治愈方法。然而,全球供体肝的短缺意味着多数患者死于等不到合适的肝脏。肝细胞疗法是一个吸引人的有望替代肝移植的方式。肝细胞在体内有很高的复制能力;然而,肝细胞分离的技术要求高,需要尸肝捐赠,并且肝细胞在体外不能够高度扩展。
胆管反应在慢性肝损伤被激活,并认为包括推测的有潜力再生肝细胞和胆管细胞的肝祖细胞(HPCs)。然而,这种再生通路的意义还不清楚。最近的研究试图利用表面标志物或者体内谱系追踪去识别HPCs。这些研究表明,HPCs在肝脏内增加,植入实质内,可能有不同的能力,但结果没有大量肝实质的再生。只有HPCs有再生能力,在体外和移植过程可扩展,这才会是未来一个有潜力的治疗目标。许多饮食以及损伤的化学模型已经开发来研究HPCs的生物性能。
小鼠实验中利用肝细胞谱系追踪已经表明,在各种肝损伤模型中HPCs对肝细胞自身再生的作用并不明显。这就使得HPCs在肝脏损伤和再生中的性质和作用令人怀疑。在小鼠进一步的实验表明,肝细胞可以转变成胆道胆管型,之后再重新转变为肝细胞。
在晚期人类肝病中,往往存在广泛的肝细胞衰老,也就是肝细胞复制中一个不可逆的过程,由P21或者P16阳性表示。在这种背景下,胆管反应发展;然而,假定HPCs在人类肝病中的职能作用很难在没有谱系追踪的情况下来识别。问题在于小鼠肝损伤模型能否充分反映人类疾病。在大鼠,完全抑制肝细胞增殖可通过使用化学毒素来实现,这引发了广泛的胆管/HPC反应,这被认为是实质再生,虽然还需要更正式的谱系追踪研究来证明。肝细胞转变为胆小管细胞破坏了其依赖性,除非是诱导发生了显著地损伤可以忽略不计。
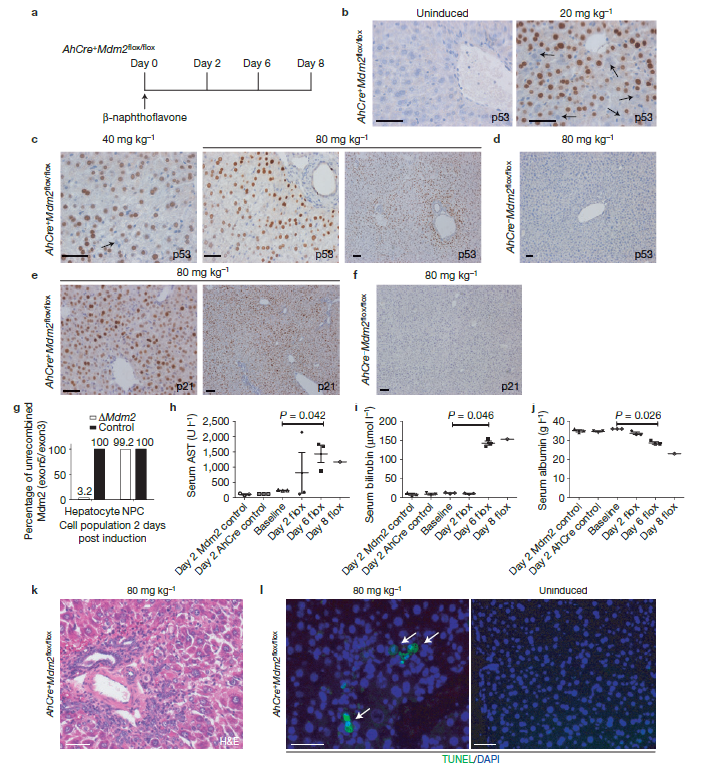
为了模拟人(和大鼠)的情况,我们已经利用了一种在成年小鼠肝脏诱导肝细胞损伤以及衰老的基因方式。我们已经用Mdm2发现了AhCre 系统,只有用βNF诱导才会活跃。用βNF诱导后,Cre重组酶在>98%的Mdm2没有活化的肝细胞中表达。Mdm2是一种E3泛素-蛋白质连接酶,其功能是降低TRP53(p53基因)。Mdm2的灭活会导致p53基因表达的上调并诱导p53-介导的肝细胞死亡和衰老。这导致整个肝脏HPCs的快速活化,增生、转变为肝细胞,并完全恢复结构和功能。
高度纯化的HPCs群体是基于一个限定的表面抗原轮廓而分离的,并在体外扩增。HPCs在体内是以肝脏再生的非竞争模式移植,它们大量地扩展与分化,重建肝脏,显著改善了肝功能和体系结构。
编译自:Hepatic progenitor cells of biliary origin with liver repopulation capacity.Nat Cell Biol,2015.
医脉通编译,转载请注明出处
评论列表: